- La química se ocupa , entre otras cosas, de intentar desentrañar el interior de la materia. La historia empezó hace muchos muchos años (aunque no en un “reino”, pero sí junto al mar), cuando los griegos debatían sobre si la materia era continua o podía dividirse en trozos cada vez más pequeños:
- Desde el error de Aristóteles, que consideraba (frente a Demócrito y Leucipo) que la materia era continua, pasaron muchos siglos (y experimentos), hasta que a comienzos del XIX Dalton postuló su famosa teoría, que hablaba de unas partículas inalterables e indivisibles, los átomos, como constituyentes de la materia, considerada por tanto discontinua.
- Los avances en electroquímica, el descubrimiento de los rayos X y de la radiactividad, y experimentos sobre la conductividad eléctrica de los gases de mediados del siglo XIX (realizados por Thomson, al que aquí podemos ver y oír, y colaboradores) sirvieron para ir un paso más allá, y conocer qué había dentro los átomos. Las evidencias llevaban a pensar en que los átomos estaban formados por partículas más pequeñas. Desde el IES Aguilar y Cano nos explican cómo se generan los rayos catódicos (método similar al de los tubos de las viejas televisiones). Se determinó que los rayos catódicos estaban constituidos por partículas negativas, de naturaleza independiente al gas encerrado en el tubo, provistas de energía cinética, por tanto con masa. Stoney, en 1891), llamó a esas partículas electrones, y poco después (hacia 1897) el mismo Thomson determinaría su relación carga/masa.
- La carga del electrón (-1,6 · 10-19 C) fue determinada por el físico americano Robert Millikan en 1911, con el siempre admirado experimento de la gota de aceite en suspensión (la serie “El universo mecánico” lo explica estupendamente en español, parte 1 y parte 2). Este esquema te ayudará a entender cómo lo hizo (o también este applet). (Calcular la masa de la gota ya es prodigioso)
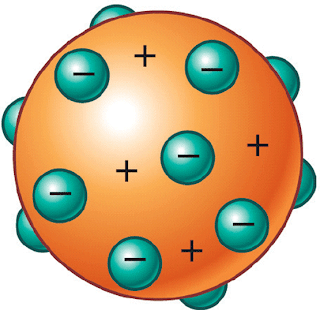
- Como el átomo era neutro, Thomson propuso en 1904 un modelo de electrones incrustados en una masa esférica con carga positiva, cual si fuera un pudin de ciruelas o de pasas:
- Otra pareja de hecho en química son los rayos catódicos y los rayos canales; en 1886, Goldstein utilizó tubos de descarga como el de Crookes, pero con el cátodo perforado, observando que además de los rayos catódicos se producían otros que atravesaban los orificios del cátodo, produciendo luminiscencia característica al chocar contra las paredes del tubo. Debían de ser partículas positivas (pues eran atraídas por el cátodo), y resultó que la relación carga/masa de las mismas dependía del gas encerrado. Rutherford repitió en 1914 la experiencia con gas hidrógeno, por ser el átomo más sencillo, comprobando que su carga positiva era similar a la del electrón y su masa unas 1836 veces mayor (1,67 · 10-27 kg). Llamó protones a estas partículas. Él mismo y Chadwick los detectaron por primera vez en 1919 al bombardear ciertos átomos con partículas α.
-
¿Qué pasó después? Que Ernest Rutherford bombardeó una delgadísima lámina de oro con rayos alfa, en un archiconocido experimento, y se llevó una gran sorpresa (¡el átomo escaba casi hueco!), lo que le llevaría a postular un nuevo modelo atómico, con un núcleo cargado positivamente y los electrones girando alrededor. La imagen resume el experimento:
- Rutherford postuló la existencia de otra partícula subatómica sin carga, con masa similar a la del protón, y que debería estar situada en el núcleo, a la vista de que la masa medida en la mayoría de los átomos era el doble de la esperada. Quedaba por descubrir el neutrón, y eso hizo Chadwick, en 1932, experimentando con reacciones nucleares, bombardeando láminas de berilio con partículas alfa, experimento que originaba radiaciones neutras formadas por partículas a las que llamó neutrones (sin carga). Desde los griegos hasta aquí, mucho se había avanzado respecto a la teoría atómica. ¿Acabaremos hablando de quarks?
- El modelo de Rutherford entraba en contradicción con las ecuaciones de Maxwell, que predecían que una carga eléctrica acelerada debía emitir energía en forma de radiación electromagnética, así que el electrón tendría que acabar estrellado contra el núcleo. Tampoco explicaba el modelo de Rutherford los espectros atómicos de emisión y absorción de los gases a baja presión, que no son continuos como los de los cuerpos calientes:
(Comprueba aquí los espectros de emisión y absorción de los elementos químicos)
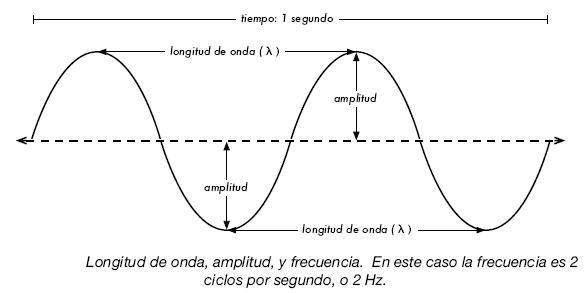
- ¿Quieres aprender un poco sobre la amplitud y la frecuencia de las ondas?
- Como interesante relación de la química con la sociedad, señalamos que los fuegos artificiales deben su alegre y diverso colorido a las sales de distintos elementos químicos, cuyos espectros de emisión por calentamiento a altas temperaturas proporciona espectáculos bellísimos. Las sales de estroncio y litio proporcionan el color rojo; para el amarillo se usan las de sodio; el cobre, para los azules; el verde se obtiene con bario; el polvo de magnesio o aluminio se utilizan para hacerlos más brillantes.
- El Proyecto Newton ofrece una sencilla presentación sobre la energía radiante, y en Educaplus, una interactividad con la que entender las transiciones electrónicas que originan los espectros.
- Había que explicar también la radiación del cuerpo negro (lo entenderás mejor con este enlace), y fue Max Planck quien encontró la solución, planteando su hipótesis sobre la cuantización de la energía:
- … Cuantización que ayudó a Einstein a explicar el efecto fotoeléctrico, introduciendo la idea de los fotones, partículas de luz, de energía en estado puro, sin masa, y que aportó un nuevo enfoque a la siempre discutida cuestión de la naturaleza de la luz:
Infografías sobre el efecto fotoeléctrico:
- Niels Bohr combinó la nueva teoría cuántica y los estudios sobre espectros (el de hidrógeno en particular) para sugerir otro modelo atómico, con el electrón moviéndose en órbitas circulares en torno al núcleo, con zonas permitidas (niveles definidos por el número cuántico principal n), y absorción o emisión de energía mediante cuantos completos. Las órbitas y los radios estaban cuantizados.
- Los saltos de los electrones entre las órbitas justificaban las líneas del espectro del hidrógeno (entiéndelo con FisquiWeb)
- El modelo de Bohr no explicaba todas las líneas del espectro, ni el efecto Zeeman, el desdoblamiento de las líneas cuando la muestra se sometía a un campo magnético muy intenso. Sommerfeld modificó dicho modelo sugiriendo la posibilidad de que el electrón describiese órbitas elípticas y circulares en un mismo nivel energético, lo que hacía necesario introducir un segundo número cuántico, el orbital o secundario, designado por la letra l. Para explicar el efecto Zeeman hubo de introducirse el número cuántico magnético, ml, relacionado con la orientación de la órbita del electrón en el espacio. Más adelante se definió el número cuántico de espín, ms, para referirse a una propiedad intrínseca del electrón relacionada con la simetría, que clásicamente se asocia la rotación del electrón sobre sí mismo.
- El siglo XX ha deparado al mundo de la física, y de paso al ser humano, un par de revoluciones muy importantes. Louis de Broglie propuso, en 1924, que la materia podía comportarse como onda o como partícula, la famosa dualidad onda-corpúsculo, basándose en las ideas de Einstein sobre la naturaleza de la luz. Así, el modelo mecánico-ondulatorio parte del átomo de Bohr y supone que las órbitas estables son aquellas cuya trayectoria es múltiplo entero de la longitud del onda del electrón. Fascinante… Somos seres ondulatorios… (Aunque con tanta masa que tiene alguna, je, je, poco se nota).
(Tiene segunda parte, pero buena, y genial información en inglés subtitulado)
- Otra revolución llegó de la cabeza de Heisenberg, que vino a acabar con el determinismo clásico con su celebérrimo Principio de incertidumbre: no es posible conocer simultáneamente el momento lineal y la posición de una partícula en movimiento. Lo que, en roman paladino, quiere decir que si sabes dónde está, no sabes a qué velocidad va, y viceversa… Así que ya no podemos hablar de órbitas determinadas para el electrón, sino de orbitales atómicos, regiones donde la probabilidad de encontrarlo es grande. Cosas veredes, Sancho.
- La mecánica cuántica y los modelos atómicos: hay que abandonar el concepto de órbita, y pasar al de orbital; de la certidumbre a la incertidumbre. ¡Qué difícil de asumir! Además del socorrido IES Aguilar y Cano, también tenemos información sobre cuántica en el Proyecto Newton y en el magnífico trabajo de Lentiscal. Si una imagen vale más que mil palabras, un vídeo ni se sabe (aunque sea en inglés con subtítulos en español)
- En el modelo de Bohr se introducía un único número cuántico n, el principal; con la corrección de Sommerfeld, se necesitaba dos (n y l). Ampliando las ideas de de Broglie, Erwin Schrödinger propuso una ecuación con la que se podía calcular la amplitud de onda del electrón en varios puntos del espacio. Las soluciones de la ecuación de ondade Schrödinger (siempre asociado al gato, vivo y muerto a la vez (el ser y no ser cuántico); la mecánica cuántica se entiende mejor en el mundo microscópico, antes que en el macroscópico) hacen depender al átomo cuántico de cuatro parámetros, de los cuales hemos hablado anteriomente. Son los números cuánticos n (principal), l(secundario, azimutal o de momento angular, ml (magnético)y ms (de espín). El cuadrado de la función de onda da la probabilidad de encontrar al electrón en un orbital. Cada orbital atómico está determinado por los tres primeros números cuánticos (n, l, ml), mientras que el electrón requiere, además, del cuarto (ms). Un nivel n contiene n subniveles, con 2l+1 orbitales, y en cada nivel caben un total de 2n2 electrones.
- En resumen, el átomo mecano-cuántico se basa en tres principios: a) el átomo y la molécula sólo existen en determinados estados energéticos; b) el cambio de energía del átomo o molécula sucede por emisión o absorción de un fotón, de energía expresada por la ecuación de Planck, E= h f; c) los estados energéticos permitidos se distinguen entre sí mediante los cuatro números cuánticos. Se pasa de la idea de órbita definida a la de orbital, superficie cerrada que representa una región del espacio donde la probabilidad de encontrar al electrón es del 90%.
Significado físico de los números cuánticos
n = 1, 2, 3, 4, … (número cuántico principal; nivel de energía)
l = 0, 1, 2, … (n - 1) (número cuántico orbital o de momento angular; subnivel de energía, forma del orbital)
(l=0, orbital s; l=1, orbital p; l=2, orbital d; l=3, orbital f)
ml = - l, … , 0, … +l (número cuántico magnético; orientación del orbital)
s = - ½ , + ½ (número cuántido de espín, rotación del electrón respecto a su eje)
- En resumen, lo que indican los números cuánticos es:
- En esta tabla tienes un resumen de todos los posibles valores de los números cuánticos.










Muy buen material y de gran ayuda al momento de trabajar.
ResponderEliminar