CURSO 17/18 IES SANTA CLARA

Scape room
TEMA0 EL CONOCIMIENTO CIENTÍFICO
Practica los conceptos aprendidos:
Notación científica y factores de conversión
Operaciones con notación científica
Factores de conversión
Operaciones con notación científica
Factores de conversión
Magnitudes y unidades
Gráficas
Cálculo de errores. Error absoluto y relativo
Gráficas
Práctica de laboratorio
- Está bien conocer los materiales y productos de un laboratorio, pero aún mucho mejor saber utilizarlos respetando las normas de seguridad. ¡Hay que prevenir los accidentes! Por ejemplo, conociendo los símbolos de peligro de las etiquetas y las normas básicas de trabajo en un laboratorio:
TEMA 1.- LA MATERIA. LOS GASES
UN UNIVERSO DE MATERIA
La materia es todo lo que ocupa materia y tiene masa. La materia forma parte de todos los cuerpos del Universo.
- Sobre la materia te llevan contando cosas desde que ibas al colegio: ¿te acuerdas de lo básico? Es aquello que tiene masa, ocupa volumen… etc. etc.

(pincha en las imágenes para verlas ampliadas)
- PROPIEDADES DE LA MATERIA
- Hay muchas preguntas sin respuestas: de dónde venimos, a dónde vamos… Pero ¿de qué estamos hechos? es menos misterio: la materia, vista por el Proyecto Newton; su estructura y cambios, su diversidad, sus propiedades… un viaje fascinante hacia el interior de lo que vemos.
- Despues de ojear las animaciones del Proyecto Newton sobre la materia, haz la autoevaluación propuesta.
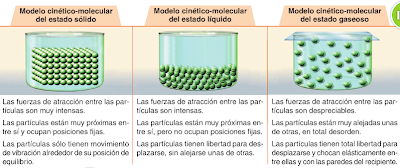
- El modelo cinético de la materia queda muy claro si se ve animadamente:
- LOS ESTADOS DE LA MATERIALA TEORÍA CINÉTICA-MOLÉCULAR
- Experimenta cómo se producen los cambios de estado (variando la temperatura), y comprueba después lo que has aprendido.
- La excelente animación que sigue (de Miguel Almodóvar Trujillo) te ayudará a entender cómo suceden los cambios de estado “por dentro”:
- Para un nivel elemental, Skoool! propone distintas lecciones sobre qué es la materia, sus características, su clasificación (parte 1 y parte 2), las propiedades de los estados de la materia y los puntos de fusión y ebullición.
- Atiende a la lección de Skoool sobre las propiedades de los estados de la materia, y realiza el test interactivo que se propone en la unidad.
- Se puede hablar largo y tendido de las propiedades de la materia y de los estados de agregación en que se encuentra. Con la animación te quedará más claro:
Realiza las siguientes actividades
TEORÍA CINÉTICA Y PRESIÓN
Concepto de Presión
Ley de Boyle
Ley de Charles
Ley de Gay Lussac
LABORATORIO EDUCAPLUS
Pinchando en la siguiente imagen, pueden testear sus conocimientos sobre distintos tipos de calibre:
TEMA 2.- LA MATERIA. LOS LÍQUIDOS.
- Pincha en la imagen, y clasifica las sustancias como se indica.
- Sigue aprendiendo a clasificar la materia en esta página y con las actividades interactivas del IES Suel.
- Las sustancias puras y las mezclas, los elementos y los compuestos, ¿en qué se diferencian?
- Repasa el tema con los libros interactivos de SM, plagados de animaciones y ejercicios “online”.
- Es mítico estudiar cómo se separan las mezclas heterogéneas. Y poner como ejemplo la destilación (especialmente, la del petróleo). Aquí tienes más información sobre los métodos de separación de mezclas heterogéneas y disoluciones, y la animación que sigue te aclarará la práctica de laboratorio que se hace en este tema.
- ¿Qué sucede si echas un puñado de sal en agua? Esta animación lo aclara.
- Se trabaja mucho sobre disoluciones en el tema dedicado a la materia; son mezclas homogéneas de composición variable.
- Qué sucede si echas un puñado de sal en agua? Esta animación lo aclara.
- Se trabaja mucho sobre disoluciones en el tema dedicado a la materia; son mezclas homogéneas de composición variable.
- Las disoluciones constan de soluto (el que se disuelve o está en menor proporción) y disolvente (el que disuelve o está en mayor proporción), y se clasifican según diferentes criterios:
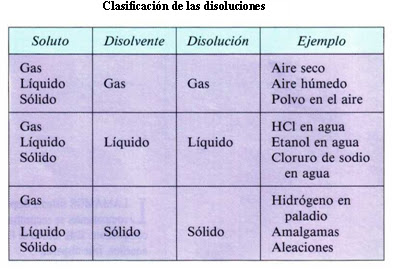
- Concentrada, diluida, saturada, sobresaturada… Mejor lo vemos con el sulfato cúprico:
- … y aprende a prepararlas en el laboratorio (antes de ir, mira el vídeo y juega con la animación). Comprueba lo que sabes.
- Cerca de las disoluciones, toca siempre comentar qué es la solubilidad y cómo se interpretan las curvas de solubilidad. Las formas de expresar la concentración de una disolución son el abc para trabajar en el laboratorio.

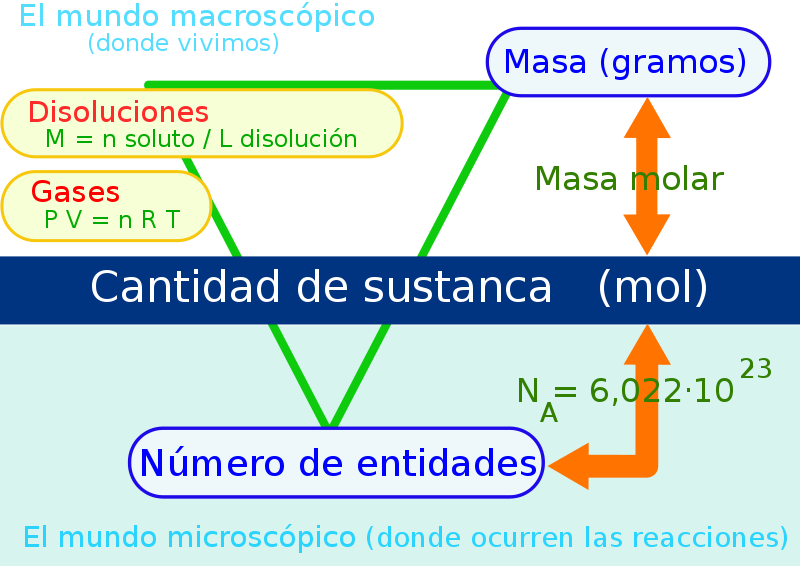
- Aunque nos queda un poco “grande” para tercero, ya puedes ir familiarizándote con el concepto de mol:
Os cuelgo ejercicios tipo examen, 10 del tema 1 y 10 del tema 2. Tenéis las soluciones en el final del documento, intentarlos. Ejercicios Temas 2 y 3
TEMA 3: ESTRUCTURA ATÓMICA
Actividades. En este documento disponéis de ejercicios de repaso del tema del átomoANIMACIONES DE LOS MODELOS ATÓMICOS
EXPERIMENTO DE RUTHERFORD
Rutherford realizó un experimento crucial para comprender la estructura interna del átomo. Bombardeo una delgadisima lámina de oro con partículas alfa, produciéndose al desintegrarse algunos elementos radiactivos.
animación del experimento de Rutherford
Detalle de la desviación de las partículas alfa por contacto con el átomo
ESTRUCTURA DEL ÁTOMO
- ELECTRÓN
Fue la primera partícula subatómica que se descubrió en 1897 por John Thomson con los tubos de rayos catódicos, determinó que se trataba de partículas con carga negativa.
En 1911 Robert Millikan consiguió calcular la carga del electrón, que resultó del orden de 10-19 culombios.
- PROTÓN
En 1886 una modificación del los tubos de rayos catódicos permitió descubrir el protón, la partícula con carga positiva. Ello fue llevado a cabo por Eugen Goldstein.
- NEUTRÓN
El neutrón no posee carga eléctrica, de ahí su nombre. Fue descubierto en 1932 por James Chadwick cuando estudiaba éste las radiaciones emitidas por una muestra de berilio bombardea con partículas alfa (partículas positivas).
LOS DATOS ACTUALES
SÍMBOLO
|
MASA/kg
|
CARGA/ C
| |
ELECTRÓN
|
e-
|
9,110 .10-31
|
-1,602 . 10-19
|
PROTÓN
|
p+
|
1,673 .10-27
|
-1,602 .10-19
|
NEUTRÓN
|
N
|
1,675 .10-27
|
0
|
CARACTERIZACIÓN DE LOS ÁTOMOS
- Masa de los átomos
Es importante para el estudio de los procesos químicos.
Expresar las masas de los átomos en gramos no parece útil, ya que es una unidad demasiado grande para una partícula tan pequeña; por eso se definió una nueva unidad, la unidad de masa atómica (u).
La unidad de masa atómica (u) equivale a la doceava parte (1/12) de la masa del átomo de carbono-12.
1 u = 1,6606 .10-27 kg
La masa del átomo= masa del núcleo, se puede despreciar la masa del electrón porque es muy pequeña comparada con la del núcleo.
Teniendo en cuenta que la masa del protón y del electrón son practicamente idénticas se deduce que:
masa protón = masa neutrón= 1 u
- Número atómico, Z, es el número de protones que tiene un átomo. Como el átomo es neutro, el número de protones coincide con el número de electrones.
Z = número de protones = número de electrones (para un átomo)
- Número másico, A, al número de partículas que tiene un átomo en su núcleo. Es la suma de los protones y los neutrones.
A = número de protones + número de neutrones
La relación existente entre ellos es: número másico = número atómico + número de neutrones
A = Z + N
Representación de un elemento
Repaso de interpretación del Z y A
ISÓTOPOS
Los Isótopos son átomos de un mismo elemento que tienen igual número de protones y electrones (igual número atómico) pero diferente número de neutrones (difieren en su masa atómica).

CONFIGURACIÓN ELECTRÓNICA de un átomo es la distribución de sus eléctrones en las diferentes capas que forman su corteza.
Orden de llenado de los orbitales

IONES
Son átomos que han perdido o ganado eléctrones de manera que adquieren carga eléctrica positiva o negativa respectivamente.
Se denomina CATIÓN, si la carga es positiva y ANIÓN, si la carga es negativa.
Constructor de cationes y aniones
Deducimos por tanto que el número de protones y neutrones no es el mismo en un ión.
Existen iones monoatómicos, es decir, formados por un único átomo que ha ganaso o pérdido electrones al interaccionar con otros átomos.
En otros muchos casos, el ión está formado por una agrupación de átomos enlazados. Se trata entonces de un ión poliatómico.
Actividades HOT POTATOES
Disponéis del diagama de Moller, utilizado para realizar las configuraciones electrónicas:

LOS ENLACES QUÍMICOS
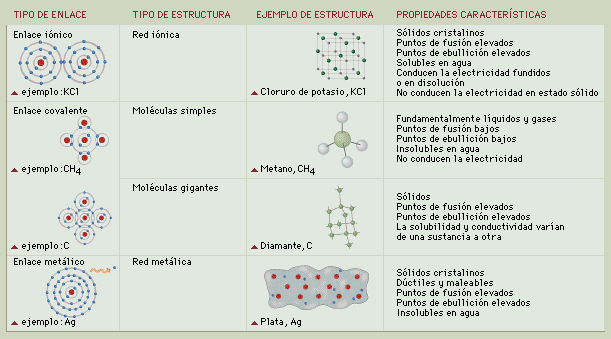
LA TABLA PERIÓDICA
HABER QUIÉN CONSIGUE MÁS PUNTOS...CONSTRUYE LA TABLA PERIÓDICA
CONTESTA A LAS SIGUIENTES PREGUNTAS, EXCEPTO LA 5, 6 Y 7. SUERTE A TODOS.
Video de la tabla periódica y su configuración
EL RAP DE LA TABLA PERIÓDICA
Video de la Tabla periódica y el principe del Bel-air
CONTESTA A LAS SIGUIENTES PREGUNTAS, EXCEPTO LA 5, 6 Y 7. SUERTE A TODOS.

Video de la tabla periódica y su configuración
EL RAP DE LA TABLA PERIÓDICA
Video de la Tabla periódica y el principe del Bel-air
Repaso Tema
REACCIONES QUÍMICAS
.gif)
Recordarás la diferencia entre cambios físicos y cambios químicos… ¿Verdad?
Para abordar este tema, lo primero es saber formular. La información necesaria la organizan, de maravilla, los del Suanzes de Avilés (FisQuiWeb), el grupo canario deLentiscal, la plataforma andaluza Averroes, la página de 100cia química o el míticoAlonsofórmula. Una presentación también te aclarará dudas.
En la tiza virtual dispones de ejercicios de auto evaluación de formulación y nomenclatura puedes seleccionar por tipo de compuesto: hidruros, óxidos y sales.
Página web Educaplus. Elige los compuestos binarios para relacionar la fórmula con la nomenclatura:
Página web Escuela Ingenierías Industriales (Universidad de Valladolid). Contiene explicaciones sobre formulación y ejercicios de autoevaluación muy útiles. En nuestro caso sólo nos interesa: combinaciones del oxígeno, combinaciones del hidrógeno, hidróxidos y sales.
Página web Juanjo El de Física. Contiene ejercicios de nomenclatura y formulación y juegos de tres en raya para formular.
¿Cómo se ajustan las reacciones químicas? (¿Recuerdas la diferencia entre cambio físico y cambio químico?) Deberías. Contando, simplemente contando. Prueba a hacerlo, la imagen también te ayudará:
Practica el ajuste de ecuaciones químicas. Puedes comprobarlo aquí, y seguir repasando estequiometría.
Reacciones químicas ajustadas