REACCIONES DE OXIDACIÓN-REDUCCIÓN (reacciones de transferencia de electrones)
- Un elemento se oxida cuando aumenta su número de oxidación, perdiendo electrones (por ejemplo, el Fe se oxida a Fe2+ o a Fe3+); la reducción implica ganancia de electrones, y disminución del número de oxidación (como ocurre cuando Ag+ pasa a Ag).
- Las reacciones de oxidación y reducción ocurren simultáneamente, una no se da sin la otra.
- ¿Qué pasa con una lámina de cinc sumergida en una disolución de sulfato de cobre (II)?
- Repasa los conceptos básicos del tema, y comprueba lo que has aprendido con un pequeño test
- Practica también en medio básico. Más ajustes redox inteactivos en Educaplus.org
Método Ión-electrón
- ¿Recuerdas que la química estaba llena de parejas? No hay oxidación sin reducción, ni viceversa. La imagen te llevará al desarrollo interactivo del tema. Una selección de contenidos teóricos y de ejercicios te pueden servir de refuerzo.
- De modo similar a las valoraciones ácido-base, se puede determinar la concentración de un agente oxidante en una disolución acuosa mediante una valoración redox (también caen en PAU). Son habituales las permanganometrías. Cuando la reacción se completa sin que sobre nada del oxidante ni del reductor, se alcanza el punto de equivalencia. El punto final se reconoce por el diferente color del indicador en su forma oxidada y en su forma reducida (en PAU piden la valoración de un agua oxigenada comercial, ojea esta animación). A ver qué pasa con la lejía doméstica:
Voxidante · Noxidante = Vreductor · Nreductor
(donde V es el volumen y N la normalidad)
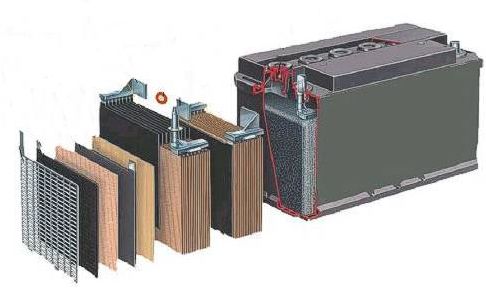
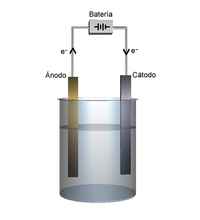
- ¡Cuánto hay que agradecer a la electroquímica en la vida diaria! ¿O acaso tendríamos móviles sin baterías, y marcapasos sin pilas? ¿Y cómo limpiaríamos la plata ennegrecida? Alessandro Volta no se dedicó a producir descargas eléctricas sobre ranas muertas para resucitarlas. ¿Cómo funciona una pila voltaica? ¿Cómo es la reacción en una pila Daniell? ¿Y la batería de los coches? Recordemos que en las pilas se produce energía eléctrica a partir de energía química, ocurriendo la oxidación de una sustancia en el ánodo (polo negativo), y la reducción de otra en el cátodo (polo positivo). Los electrones circulan del ánodo al cátodo.
- Todo esto de las pilas tiene mucho que ver con el comportamiento de los metales en disolución (si te apetece verlo, pero escuchándolo en inglés, siempre hay vídeos):
- No dejes de ver esta animación narrada sobre la célula galvánica.
- Las magnitudes físicas (aquellas que se pueden medir) necesitan que exista el cero, la representación de la nada. Como no es posible conocer el potencial de un electrodo aislado (sólo la diferencia entre dos electrodos), ¿dónde ponemos el listón más bajo? Por consenso, que en la ciencia a menudo se consigue, se asigna ese valor cero al electrodo estándar de hidrógeno:
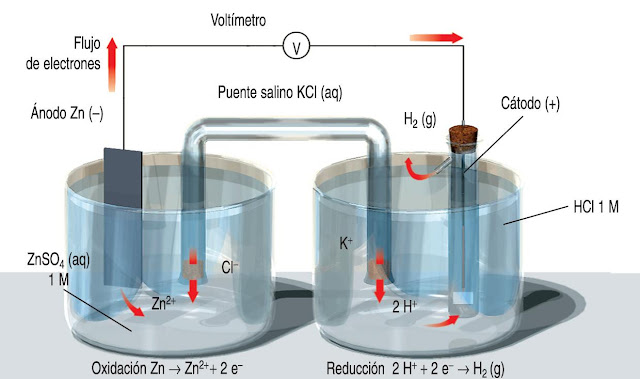
- El mítico ejemplo de la pila de cobre/cinc. ¿Qué ocurre a nivel atómico? (Más aún en este vídeo en inglés, o en la animación de debajo de la imagen).

- El potencial estándar del cobre se mide montando una pila cuyo funcionamiento, ecuaciones anódica, catódica y global debes saber deducir de la notación abreviada que sigue:
Pt | H2(g, 1 atm) | H+(1M) || Cu+2(1M) | Cu(s)

- El potencial estándar de reducción del cinc se mide con un montaje similar al anterior (y el de cualquier metal).
- Recuerda que el potencial estándar de una pila se calcula como:
Eºpila = Eº cátodo - Eº ánodo
y que para expresar la composición de una pila (como la Daniell del ejemplo) se sigue una notación similar a:
Zn (s)| Zn2+(aq, 1 M) | | Cu2+(aq, 1M) | Cu (s)
Se escribe a la izquierda el ánodo, donde se produce la oxidación, y a la derecha el cátodo, donde se produce la reducción; se indica entre paréntesis la fase en la que se encuentra cada especie, separándose con una barra vertical las especies que están en diferente fase; la doble barra vertical del medio indica el puente salino. El proceso será espontáneo siempre que la el potencial de la pila, Eº, sea positivo (o lo que es lo mismo, Eº cátodo > Eº ánodo).
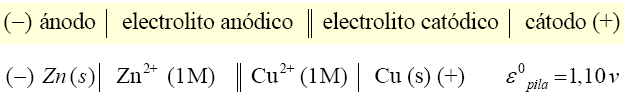
- En todos los ejercicios de pilas te será imprescindible una lista de potenciales estándar de reducción (Eº). Hablando de pilas, hay varios tipos, como habrás comprobado en las tiendas, y formas de clasificarlas (por ejemplo, en primarias, secundarias o acumuladores y de combustible) ¿Pruebas con una webquest?
- Una colección de ejercicios con soluciones, y otros resueltos de selectividad; repaso con respuestas (modelo A y modelo B), enunciados y soluciones “on line”; archivos pdf con problemas y soluciones, y más; ejercicios propuestos, con las respuestas a un click, y otro click… Imposible no practicar, habiendo voluntad, y otros ejercicios, je, je. Siempre puedes repasar el tema en el Proyecto Ulloa.

- Es más que recomendable tener idea de qué va eso de las pilas de combustible (para cuando repostemos con aire, o casi ya; los del IES Barredos, de Laviana, han desarrollado su coche de hidrógeno). El problema sigue siendo cómo almacenar el hidrógeno:
- No hay que descuidar el trabajo en el laboratorio, pero los que programan las asignaturas deben pensar que la dilatación del tiempo, factible y matemáticamente demostrable desde la teoría de la relatividad, funciona a velocidades muy inferiores a las de la luz (lo único que comprobable por estos lares es la contracción de longitudes… no hay más que mirar dentro de los cerebros).
- Esta imagen, recreación de los experimentos de Volta con ranas, te llevará al tema de Digital Text sobre oxidación-reducción, de nivel elemental, bueno para afianzar ideas:
- Uno de los efectos no deseados de los procesos redox es la corrosión (aunque a vecesno resulta tan negativo). Menos mal que tiene soluciones varias, y se explican perfectamente en este click. ¡A protegerse!
- ¿Alguna vez habéis pensado cómo se obtienen el cloro o el hidrógeno? ¿O si es posible separar el sodio de la sal común? Seguramente, tendréis asuntos mejores de los que ocuparos. Lo que sí se os sonará son los cromados de coches y motos, las joyas “bañadas en oro”, el galvanizado de los quitamiedos, o la expresión “quedó niquelao“, sinónimo de perfecto y brillante. Todo esto para hablar de la electrolisis, el procesomedidante el cual la energía eléctrica se transforma en energía química, forzando una reacción redox no espontánea. Al igual que en las pilas, se produce oxidación en el ánodo y reducción en el cátodo, pero ahora se invierte la polaridad de ambos: el ánodo es el polo positivo y el cátodo es el negativo. Se precisa una corriente continua para que la reacción progrese en una celda electrolítica:
- Como los alumnos tienen siempre ansias de laboratorio, incrusto el vídeo de una sencilla práctica “casera”, la electrolisis del cloruro de sodio disuelto en agua (que no fundido, importante diferencia), no exenta de ciertos riesgos (el catión sodio no se deposita como sodio, sino que produce hidróxido de sodio, siendo los cationes de hidrógeno los que se reducen en el ánodo; los gases generados son cloro e hidrógeno). Mejor ver (y entenderlo con la lección de Skoool!) que hacer, en este caso:
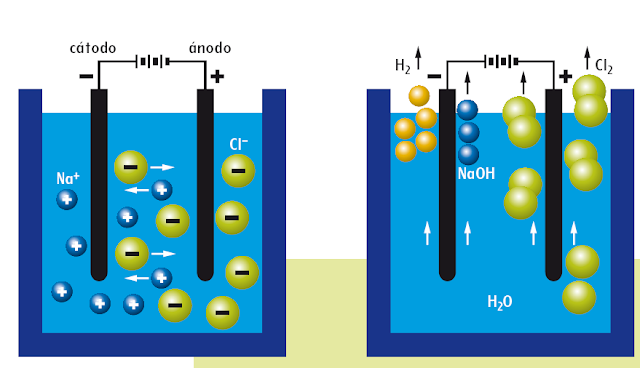
- Una disolución de cloruro de sodio contiene las especies Na+, Cl- y los iones hidronio (H+) e hidroxilo (OH-) provenientes del agua. Las posibles ecuaciones químicas de la electrolisis del cloruro de sodio en disolución son:

- A la vista de los potenciales de oxidación (en el ánodo) y de reducción (en el cátodo), queda claro que los aniones cloruro tienen más tendencia que el agua a oxidarse, y que el agua agua tiene más tendencia a reducirse que el catión sodio, por lo que la reacción global resultante es la que produce hidrógeno y cloro gaseoso:
2 Cl- (aq) + H+ (aq) —> Cl2 (g) + H2(g)
- La electrolisis del cloruro de sodio fundido (Na Cl a unos 800º C), que permite obtener sodio líquido y cloro gaseoso, responde a estas ecuaciones químicas:
Na Cl (s) –>fusión –> Na Cl (l) —> Na+ (l) + Cl- (l)
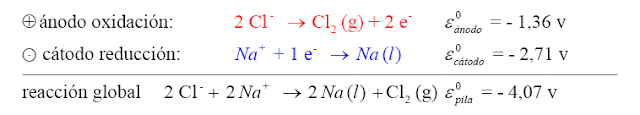

- Es imprescindible conocer la electrolisis del agua, con la que se obtiene hidrógeno y oxígeno, y tener claras las ecuaciones de oxidación y reducción que se producen, además de los valores de los potenciales (en condiciones estándar o no). El voltámetro de Hofman es el aparato con que se realiza la electrolisis del agua en el laboratorio. Puedes ojear este vídeo, su continuación y la animación en flash.

Ánodo:
2 H2O(l) → O2(g) + 4H+(aq) + 4 e- E(oxidación agua)= - 0,81 V (pH=7)
Cátodo:
2H2O(l) + 2e− → H2(g)+ 2OH−(aq) E(reducción agua)= - 0,42 V (pH=7)
2H2O(l) → 2H2(g) + O2(g) Eelectrolisis agua (pH=7) = - 0,42 - 0,81 = - 1,23 V
(para lograr la electrolisis del agua se necesitarán, al menos, 1,23 V, aunque en la práctica se precisa un voltaje mayor -de 1,6 a 1,8 V- por el fenómeno de sobretensión, debido a la naturaleza de los electrodos y la presencia de gases)
- Observa que los valores de potencial estándar de reducción se utilizan para concentraciones 1 M y presión 1 atm. En las tablas de potenciales estándar de reducción aparecen las siguientes ecuaciones y valores (compáralos con los anteriores):
2H2O(l) + 2e− → H2(g)+ 2OH−(aq) Eº(H2O/H2) = - 0,83 V
O2(g) + 4H+(aq) + 4 e- → 2 H2O(l) Eº(O2/H2O)= + 1,23 V








No hay comentarios:
Publicar un comentario