martes, 27 de octubre de 2015
1º BACHILLERATO GASES REALES
GASES REALES
1.- ¿Qué se entiende por gas real?
2.- ¿Qué son las isotermas de Andrews?
3.-¿Qué representa la curva de saturación?
4.- Define la presión de vapor
5.- ¿Qué es la ecuación de Van der Waals? Indica cada uno de sus términos.
6.- ¿En qué condiciones un gas real se comporta como ideal?
lunes, 26 de octubre de 2015
3.-LEYES DE LOS GASES
En la página de la Junta de Andalucía dispones de recursos interesantes de las leyes de los gases.
En el siguiente enlace puedes ver un resumen de los contenidos principales de este tema. Además también puedes ir en ella al laboratorio virtual y experimentar con los conceptos aprendidos.
La teoría cinética resulta fundamental para comprender las propiedades de la materia.
animaciones flash teoría cinético-molecular.
Este video tiene animaciones muy visuales sobre como la teoría cinético molecular explica la leyes de los gases.
domingo, 25 de octubre de 2015
viernes, 23 de octubre de 2015
FORMULACIÓN Y NOMENCLATURA INORGÁNICA
Formulación y nomenclatura
Comienza repasando los conceptos aprendidos en la ESO, son fundamentales para el comienzo de este tema.
Apuntes 1º bachillerato compuestos binarios
Apuntes 1º bachillerato compuestos ternarios
En los siguientes enlaces puedes practicar los conceptos aprendidos:
jueves, 22 de octubre de 2015
EQUILIBRIO 2º BACHILLERATO
EQUILIBRIO QUÍMICO

La conversión de reactivos en productos casi nunca es total; en determinado momento, las cantidades de reactivos y productos permanecen constantes en el tiempo. Es el estado de equilibrio químico, reversible y dinámico: reversible porque se puede alcanzar el mismo estado partiendo de reactivos o de productos, y dinámico porque la reacción no se para en el equilibrio, sino que la velocidad de conversión de reactivos en productos es igual a la de productos en reactivos.
Animación de concentraciones de equilibrio
En el siguiente enlace puedes interactuar para ver como es la evolución de las concentraciones de los reactivos y productos en función de la constante de equilibrio.
Animación de la constante de equilibrio
A continuación dispones de ejercicios resueltos de equilibrios homogéneos.
En el siguiente enlace puedes interactuar para ver como es la evolución de las concentraciones de los reactivos y productos en función de la constante de equilibrio.
Animación de la constante de equilibrio
A continuación dispones de ejercicios resueltos de equilibrios homogéneos.
Se distinguen entren equilibrios homogéneos y heterogéneos según los reactivos y productos se encuentren en la misma o distinta fase.
Para una reacción genérica a A + b B <–> c C + d D, la expresión de la constante de equilibrio (Kc o Kp) en función de las concentraciones o de las presiones parciales es:
(en ambas expresiones, sólo intervienen las sustancias en estado gaseoso; para equilibrios heterogéneos, se consideran constantes tanto la presiones parciales como las concentraciones de líquidos y sólidos, interviniendo sólo gases y especies en disolución -aq-)
¿Cómo se relacionaba la energía libre de Gibbs con la constante de equilibrio? ¿Hay que repasar el tema de termoquímica? ¿Recuerdas que ΔG = ΔGº + R T ln Q, para cualquier condición de presión y temperatura? Q es el cociente de la reacción.- Si una reacción se puede expresar como suma de otras, la constante de equilibrio de la reacción global es el producto de las constantes de equilibrio de cada una de las reacciones individuales.

- Cuando la reacción es reversible, sucede que ΔG = 0, y Q equivale a la constante de equilibrio, K. Con unas pocas de matemáticas, a partir de 0 = ΔGº + R T ln K, si despejamos: ln K = - (ΔGº)/ R T, así que…
(con R=8,3 J/K mol
Las constantes de equilibrio se toman, en general, como números adimensionales (desde el punto de vista termodinámico, son el resultado de elevar el número e a un exponente; experimentalmente Kc y Kp podrían tener unidades, ya que las concentraciones se miden en mol/l y las presiones en atmósferas). Podemos relacionar Kp, Kc y Kx aplicando la ecuación de los gases ideales (P V = n R T) y la definición de fracción molar:
Kp = Kc (R T) Δn = Kx PΔn
(siendo P la presión total, R= 0,082 atm l /K mol y Δn la variación del número de moles ¡gaseosos!)
- ¿Podemos predecir la evolución de un sistema conociendo Q y Kc?
Es complicado abandonar el sofá; ¿a quién le gustan las alteraciones? Todo en la vida es física y química (decía el ilustre Don Severo Ochoa); no queremos abandonar el equilibrio, como les sucede a las reacciones químicas: en cuanto se produce una alteración del sistema, éste responde evolucionando hacia un nuevo estado de equilibrio, de composición diferente. Es el famoso principio de Le Chatelier. En la siguiente animación se analizan los efectos de las variaciones de concentración, la presión y la temperatura sobre el equilibrio.
Animaciones de equilibrio (Química100c)son un magnífico recurso para entender la influencia de la Concentración, presión, temperatura y catalizadores.
Magnífica animación en inglés de MacGraw Hill para comprender el principio de Le Chatelier.
Efecto de la presión (en Skoool)
En el siguiente enlace resulta interesante el resumen de lo visto sobre equilibrio químico
Problema equilibrio químico PAU 2002-2006 Castilla y León
Problemas resueltos de PAU Cantabria 2002-2011
En el siguiente enlace puedes apreciar importantes aplicaciones del equilibrio químico.
Aplicaciones del equilibrio químico analizadas desde un punto de vista termodinámico y cinético
Puedes jugar ahora al trivial del equilibrio químico, y poner en juego los conceptos aprendidos:
Trivial equilibrio químico
Problema equilibrio químico PAU 2002-2006 Castilla y León
Problemas resueltos de PAU Cantabria 2002-2011
En el siguiente enlace puedes apreciar importantes aplicaciones del equilibrio químico.
Aplicaciones del equilibrio químico analizadas desde un punto de vista termodinámico y cinético
Puedes jugar ahora al trivial del equilibrio químico, y poner en juego los conceptos aprendidos:
Trivial equilibrio químico
TERMOQUÍMICA 2º BACHILLERATO
TERMOQUÍMICA
Resumen tema termoquímica
Lo que nos interesa en termoquímica es calcular el calor y el trabajo intercambiados en los procesos químicos. Hay que prestar atención a las condiciones en que se dan esos procesos (con cambio (1) o no (2) de estado, para el calor; cómo son P, T, V, Q… para el trabajo), y a las unidades en que nos dan los datos:
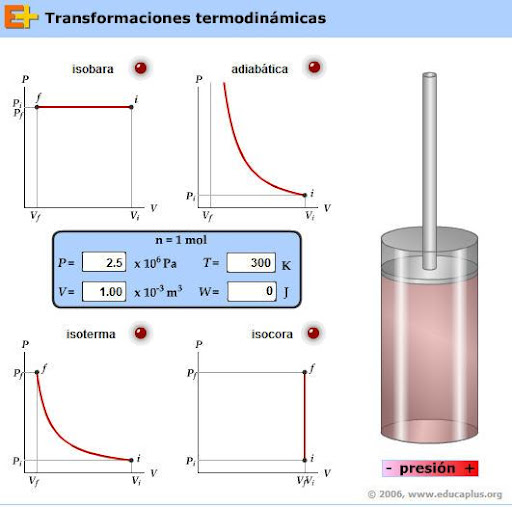
En la siguiente animación tienes representadas las distintas transformaciones termodinámicas:
Según el primer principio de la termodinámica la energía ni se crea ni se destruye sólo se transforma. La forma de enunciarlo cuando no hay variaciones de energía potencial y cinética es:
Como la mayor parte de los procesos trancurren a presión constante (la atmosférica), es útil definir una nueva función de estado, que represente el calor intercambiado en esas circunstancias (Qp). Esta función se llama entalpía (H). La relación entre su variación y la variación de energía interna ofrece expresiones muy interesantes, que siempre tienen presente el primer principio de la termodinámica:

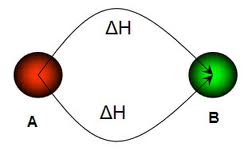
En ocasiones, no es posible llegar a la meta por el camino más rápido, y es mejor dar algún que otro rodeo. Como la entalpía es función de estado, la ley de Hess nos indica que la variación de entalpía de un proceso directo es igual a la suma de las variaciones de entalpía de cada uno de los etapas que dan lugar al mismo. Vamos, que todos los caminos llevan a Roma:
Una consecuencia de la Ley de Hess es que la entalpía de una reacción se puede determinar a partir de:
Si lo que estudiamos es la entalpía estándar de reacción, estaremos trabajando a 1 atm de presión , 25º C y disoluciones 1 M. Debemos ajustar la ecuación termoquímica convenientemente (por ejemplo, si es de formación, para obtener 1 mol del compuesto, como en la reacción de formación del agua, H2(g) + ½ O2(g) —> H2O(l) ). La fórmula anterior se mantiene, indicando el estado estándar con un º de superíndice. Comprueba que se cumple con el siguiente ejercicio ”on line”.
ΔH0 = ΔH0productos - ΔH0reactivos
- Hay procesos que implican un nombre específico para las entalpías implicadas: por ejemplo, los de combustión (que tiene como productos dióxido de carbono y agua) y los de hidrogenación (la adición de hidrógeno a 1 mol de una sustancia insaturada). Otro caso es el de las entalpías de enlace, definida como la energía necesaria para romper un mol de enlaces entre átomos en estado gaseoso:
¿Cómo sabemos si la entropía del universo ha aumentado o disminuido? Sería bastante más sencillo comprobar cómo ha sido la variación de entropía de nuestro sistema (esa pequeña parte que estudiamos). Considerando que la temperatura del entorno no se ve afectada por la absorción o cesión de calor por parte del sistema, y que la mayor parte de los procesos tienen lugar a presión constante, sucederá que:
Semejante conclusión nos llevará a definir una nueva (¡y última!) función termodinámica, la energía libre de Gibbs (G):
G = H - T S
cuya variación (¡oh, sorpresa!), es, justamente:
ΔG = - T Δ Suniverso
lo que queríamos, ni más ni menos, una forma de relacionar la variación de entropía del universo con datos de nuestro sistema. La variación de la energía libre de Gibbs en un proceso se calculará como:
ΔGreac = ∑ΔGproductos - ∑ΔGreactivos
Con la siguiente interactividad, cómo varía la energía libre de Gibbs:
No nos sorprenderá ya, a estas alturas, que la energía libre de formación estándar (Gºf) se defina como ΔG para un proceso en el que se forma 1 mol de un compuesto a partir de sus elementos, en condiciones estándar y en su estado termodinámico más estable. Para los elementos, ΔGºf =
¿Y para qué queríamos G? Para poder predecir la espontaneidad de las reacciones en función de variables de nuestro sistema, en lugar de fijándonos en la variación de entropía del universo (aunque es lo que en el fondo decide). El criterio de espontaneidad de una reacción es:
Para predecir cualitativamente la espontaneidad o no de una reacción, hay que tener en cuenta los valores de entalpía, temperatura y entropía. Una imagen, mejor que mucho rollo:
La última ecuación del tema será la que nos ayude a calcular ΔG cuando el proceso se desarrolla en condiciones no estándar, o en el caso de que el sistema esté en equilibrio:
- Haz click en la imagen y verás un archivo PDF con cuestiones y problemas "propuestos " en Selectividad.
REPASO CURSOS ANTERIORES 2º BACHILLERATO
1.- REPASO DE CURSOS ANTERIORES
 Número de Avogadro
Número de Avogadro


En donde ni indica el número de átomos del elemento i considerado y PMi la masa atómica de dicho elemento.

En compuestos covalentes, se obtiene simplificando los subíndices de la fórmula, si ello es posible, dividiéndolos por un factor común. Así, la fórmula empírica de la glucosa (C6H12O6) es CH2O, lo cual indica que por cada átomo de C, hay dos átomos de H y un átomo de O. Los subíndices siempre son números enteros y si son iguales a 1, no se escriben.
En compuestos iónicos la fórmula empírica es la única que podemos conocer, e indica la proporción entre el número de iones de cada clase en la red iónica. En el hidruro de magnesio, hay dos iones hidruro por cada ión magnesio, luego su fórmula empírica es MgH2.
En compuestos no-estequiométricos, como ciertos minerales, los subíndices pueden ser números decimales. Así, el óxido de hierro (II) tiene una fórmula empírica que varía entre Fe0,84O y Fe0,95O,lo que indica la presencia de huecos, impurezas y defectos en la red.
La fórmula molecular, indica el tipo de átomos presentes en un compuesto molecular, y el número de átomos de cada clase. Sólo tiene sentido hablar de fórmula molecular en compuestos covalentes. Así la fórmula molecular de la glucosa es C6H12O6, lo cual indica que cada molécula está formada por 6 átomos de C, 12 átomos de H y 6 átomos de O, unidos siempre de una determinada manera.




Lectura de las reacciones químicas
Ajuste de las reacciones químicas
Proyecto Descartes Reacciones Químicas
*** En estos métodos estequiométricos hay que tener en cuenta:El reactivo limitante, la riqueza y el rendimiento de la reacción.
Concepto de mol
Composición centesimal
Cuando se conoce la fórmula de un compuesto, su composición química se expresa como el porcentaje en peso de cada uno de los elementos que la componen. La composición centesimal indica el porcentaje en masa, de cada elemento que forma parte de un compuesto.
Para calcular la composición centesimal de cada elemento, se aplica la siguiente expresión:
Para calcular la composición centesimal de cada elemento, se aplica la siguiente expresión:
En donde ni indica el número de átomos del elemento i considerado y PMi la masa atómica de dicho elemento.
Ejemplo:
Fórmula empírica y molecular
La fórmula empírica es una expresión que representa la proporción más simple en la que están presentes los átomos que forman un compuesto químico. Es por tanto la representación mas sencilla de un compuesto. Por ello, a veces, se le llama fórmula mínima.En compuestos covalentes, se obtiene simplificando los subíndices de la fórmula, si ello es posible, dividiéndolos por un factor común. Así, la fórmula empírica de la glucosa (C6H12O6) es CH2O, lo cual indica que por cada átomo de C, hay dos átomos de H y un átomo de O. Los subíndices siempre son números enteros y si son iguales a 1, no se escriben.
En compuestos iónicos la fórmula empírica es la única que podemos conocer, e indica la proporción entre el número de iones de cada clase en la red iónica. En el hidruro de magnesio, hay dos iones hidruro por cada ión magnesio, luego su fórmula empírica es MgH2.
En compuestos no-estequiométricos, como ciertos minerales, los subíndices pueden ser números decimales. Así, el óxido de hierro (II) tiene una fórmula empírica que varía entre Fe0,84O y Fe0,95O,lo que indica la presencia de huecos, impurezas y defectos en la red.
La fórmula molecular, indica el tipo de átomos presentes en un compuesto molecular, y el número de átomos de cada clase. Sólo tiene sentido hablar de fórmula molecular en compuestos covalentes. Así la fórmula molecular de la glucosa es C6H12O6, lo cual indica que cada molécula está formada por 6 átomos de C, 12 átomos de H y 6 átomos de O, unidos siempre de una determinada manera.

Disoluciones
Las formas de expresar una disolución son:

Reacciones químicas
Lectura de las reacciones químicas
Ajuste de las reacciones químicas
Proyecto Descartes Reacciones Químicas
¿Cómo se resuelven ejercicios de estequiometría?
La estequiometría es una herramienta indispensable para la resolución de problemas tan diversos como la determinación de la concentración de calcio en una muestra de agua, la de colesterol en una muestra de sangre, la medición de la concentración de óxidos de nitrógeno en la atmósfera, etc.
Tipos de cálculos estequiométricos.
• Con moles.
• Con masas.
• Con volúmenes (gases)
• En condiciones normales.
• En condiciones no normales.
• Con reactivo limitante.
• Con reactivos en disolución (volúmenes).
Para resolver ejercicios de estequiometría podemos utilizar el siguiente esquema:
1) Escriba la ecuación química y establezca el balance de masa.
2) Coloque el estado de agregación de los reactantes y productos, si dispone de dicha información.
3) Identifique en la reacción química, los datos y la incógnita del problema.
4) Convierta la información suministrada en unidades físicas (por ejemplo gramos) en una unidad química adecuada (por ejemplo en moles, moléculas, iones, etc.).
4) Plantee las relaciones molares a través de la ecuación química balanceada.
5) Convierta los moles a la unidad solicitada gramos, moléculas, volúmenes, iones, etc
*** En estos métodos estequiométricos hay que tener en cuenta:El reactivo limitante, la riqueza y el rendimiento de la reacción.
Disponéis de los ejercicios de cálculos estequiométricos.
lunes, 19 de octubre de 2015
Manómetro
El manómetro es un instrumento utilizado para la medición de la presión en los fluidos.
Pero ¿Cómo funciona? ¿Qué tipos conoces? Espero vuestras respuestas:
Pero ¿Cómo funciona? ¿Qué tipos conoces? Espero vuestras respuestas:
Suscribirse a:
Entradas (Atom)