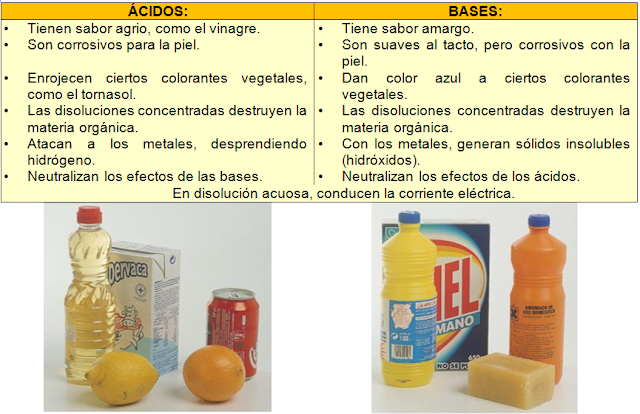
En la siguiente unidad didáctica tienes información global sobre los ácidos y bases:
El siguiente power point se muestra un resumen de la información más relevante de ácidos y bases, es el que hemos seguido en clase:
Ya en el siglo XIX, el químico sueco (de impronunciable nombre) Svante
Arrhenius intuyó que la conductividad eléctrica de las disoluciones acuosas se debía a la existencia de iones positivos y negativos en las mismas.
A principios del siglo XX, Johannes
Brönsted y Thomas
Lowry publicaron su teoría sobre los ácidos y las bases. Las características de la misma se resumen en la siguiente tabla:
La teoría cuasidefinitiva sobre ácidos y bases es la de
Lewis, pero no toca darlo este curso.
Las sustancias que se comportan como ácidos o como bases dependiendo de a qué sustancias se enfrenten se denominan
anfóteras o anfipróticas. Ejemplos de ellas son el agua, el hidrogenocarbonato (HCO3
-), el hidrogenosulfuro (HS
-) etc. Veamos qué sucede con este último:
HS- (ácido 1)+ NH3 (base 2)<–> S2- (base 1)+ NH4+ (ácido 2)
H3O+(ácido 1) + HS- (base 2) <–> H2O(base 1) + H2S (ácido 2)
El agua pura conduce muy mal la corriente eléctrica (es una sustancia covalente molecular, cuyas moléculas se unen mediante enlaces por puente de hidrógeno). Apenas está disociada en sus iones (hidroxilo e hidronio), por lo que el equilibrio de autonionizacion del agua está muy desplazado hacia la izquierda:
(Esta imagen, por cierto, lleva a una
página donde se desarrollan todos los contenidos del tema)
H2O (l) + H2O (l) <— —> H3O+ (aq) + OH- (aq)
 = 10-7 · 10-7 = 10-14 (a 25º C)
= 10-7 · 10-7 = 10-14 (a 25º C)
y de ahí se deduce la relación
pH + pOH = 14
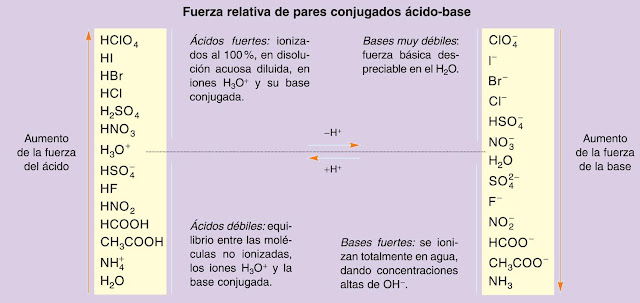
Que todo es relativo lo tenemos acuñado desde Einstein. La fuerza de los ácidos y las bases, su tendencia a ceder o captar protones, también es relativa, porque depende de con quién se enfrenten. No obstante, tenemos que conocer cuáles son los ácidos y bases más fuertes:
- Cuanto más fuerte es un ácido, más débil es su base conjugada, y viceversa:
Los ácidos y bases fuertes tienen el equilibrio de disociación casi totalmente desplazado a la derecha (una constante grandísima), son electrolitos fuertes. Cuando nos den valores de la constante de acidez o basicidad menores de 1, debemos pensar en ácidos y bases débiles, y tratar la situación como un equilibrio químico.
(base fuerte)
En numerosos envases de productos de limpieza habrás leído eso de “pH neutro”. Con la siguiente animación tendrás información sobre el concepto de pH (ese “misterioso” logaritmo)… ¡en inglés! Pero las fórmulas son universales:
pH = - log [H3 O+]
La famosa escala de pH sitúa las sustancias ácidas con valores por debajo de 7, y las básicas por encima. pH neutro será el que presente una disolución con concentración de hidronios igual a 10-7 M, y por tanto tenga pH = 7:
Los indicadores ácido-base son sustancias orgánicas que cambian de color al pasar de la forma ácida a la básica. Este cambio se produce en un intervalo denominado intervalo de viraje, característico de cada indicador:
H In (color A) + H2O <–> In- (color B) + H3O+
Los
indicadores ácido-base son electrolitos débiles que presentan colores diferentes dependiendo del pH de la disolución en que se encuentren. En la siguiente
animación puedes dar un valor aproximado del intervale de viraje de distintos indicadores. Comprueba que concuerdan con lo esperado.
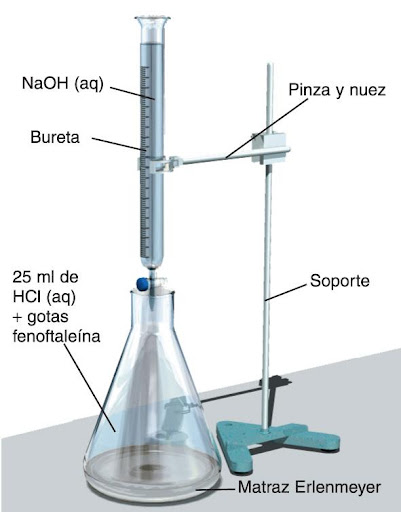
Utilizamos los
indicadores para determinar el punto final de una
neutralización, que es la reacción entre un ácido y una base para dar una sal. El punto final
se puede observar por la variación del color del indicador, mientras que el
punto de equivalencia, aquel en el que el número de hidronios iguala al de hidroxilos (el momento de la neutralización completa), sólo puede ser determinado teóricamente. Es muy conveniente elegir un indicador cuyo intervalo de viraje esté en las proximidades del punto de equivalencia..